Urothelkarzinom (Blasenkarzinom)

Seitennavigation
Das Urothelkarzinom, auch Harnblasenkarzinom oder Blasenkarzinom genannt, ist in Deutschland bei Männern die viert-, bei Frauen die zwölfthäufigste Tumorerkrankung. Histologisch handelt es sich überwiegend um Urothelkarzinome (UC), die je nach Ausbreitung unterteilt werden: nicht-muskelinvasives Blasenkarzinom (NMIBC), muskelinvasives Blasenkarzinom (MIBC) und metastasiertes Urothelkarzinom (mUC).1
Die Behandlung des Urothelkarzinoms hängt von der Histologie, dem Stadium und den Risikofaktoren ab. Das NMIBC weißt im allgemeinen eine geringe krankheitsspezifische Mortalität auf. Neben minimalinvasiven Verfahren steht eine enge Nachsorge zur frühen Erkennung von Rezidiven im Vordergrund. Beim MIBC kommen interdisziplinäre Behandlungskonzepte zum Einsatz.2 Beim fortgeschrittenen inoperablen oder metastasierten Urothelkarzinom kommen vorwiegend medikamentöse Therapieoptionen zum Einsatz, jedoch besteht weiterhin ein hoher ungedeckter therapeutischer Bedarf.3
Ca. 25 % der Patient:innen mit fortgeschrittenem oder metastasiertem Blasenkrebs kommen für die derzeitigen Therapieoptionen aufgrund mangelnder Fitness nicht in Frage, in der Zweitlinie bleiben sogar ca. 66 % der Patient:innen ohne Behandlungsoption4. So definiert auch die EAU-Leitlinie bisher keine etablierte Standardtherapie für mUC Patient:innen, die keine platinhaltige Chemotherapie erhalten können.5
Grundlagen


Biomarker Testung


 Grundlagen
Grundlagen

Epidemiologie, Krankheitsstadien und Prognose des Urothelkarzinoms
Wie häufig ist das Urothelkarzinom bei Männern und Frauen?
In Deutschland ist der Blasenkrebs bei Männern die viert-, bei Frauen die zwölfthäufigste Tumorerkrankung. Frauen erkranken seltener am Harnblasenkarzinom, haben aber eine höhere Mortalität. Zu den wichtigsten Risikofaktoren gehören aktives und passives Rauchen sowie chemische Substanzen, wie aromatische Amine.1
In welche Krankheitsstadien wird das Urothelkarzinom eingeteilt?
Die Erkrankung wird unterteilt in das nicht-muskelinvasive Blasenkarzinom, das muskelinvasive Blasenkarzinom und das metastasierte Karzinom. Histologisch werden die meisten Karzinome der Harnblase als Urothelkarzinome (90 %) klassifiziert.6 Unter den nicht-urothelialen Karzinomen sind die Plattenepithel- und Adenokarzinome am häufigsten vertreten, sehr selten sind Sarkome, Lymphome und Melanome.2
Die meisten Harnblasenkarzinome werden in frühen Stadien diagnostiziert:
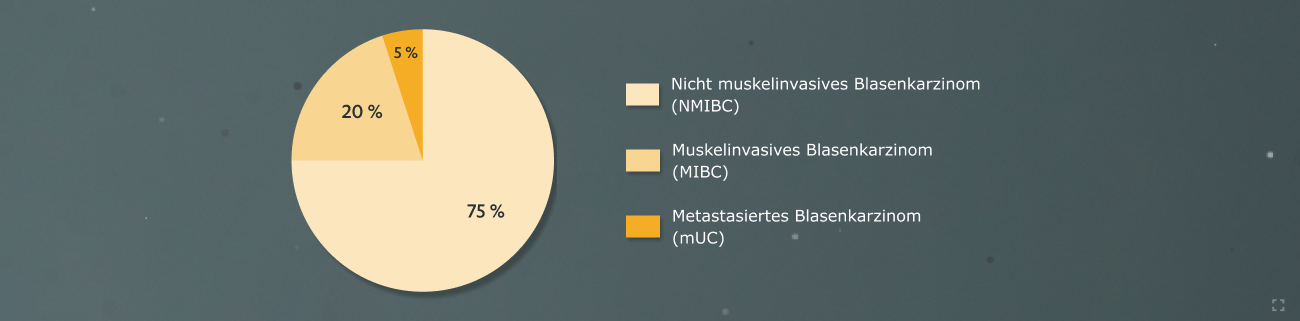

- fast 3/4 aller neu diagnostizierten Karzinome (Ta, Tis, T1)
- 7-40 % entwickeln sich zu MIBC binnen 5 Jahre7

- etwas weniger als 1/4 aller neu diagnostizierten Karzinome (T2-T4)
- erhöhtes Risiko für Progress und Rezidiv
- ca. 50 % entwickeln sich zu einer metastasierten Erkrankung weiter7,8

- der kleinste Anteil der Blasenkarzinome bei Erstdiagnose sind fortgeschritten oder mit Metastasierung (M1).8
Urothelkarzinom: Wie ist die Prognose?
Das 5-Jahres-Überleben beim Harnblasenkarzinom
Die Prognose des Harnblasenkarzinoms wird insbesondere durch die Lokalisation des Tumors, das Stadium, das Grading, die Ausbreitung, ein begleitendes Carcinoma in situ, Patient:innencharakteristika (Alter, Geschlecht, Fitness) und Komorbiditäten (z.B. eingeschränkte Nierenfunktion) sowie molekulare Marker bestimmt.6
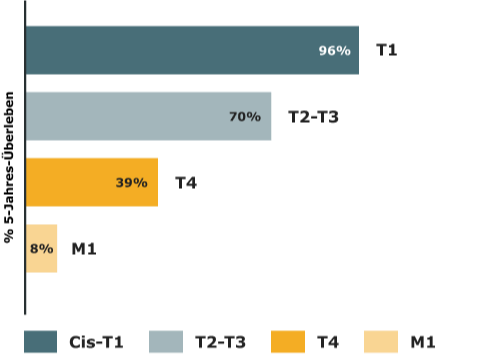
mod. nach (9)
 Diagnostik
Diagnostik

Diagnose, Klassifikation und Stadieneinteilung des Urothelkarzinoms
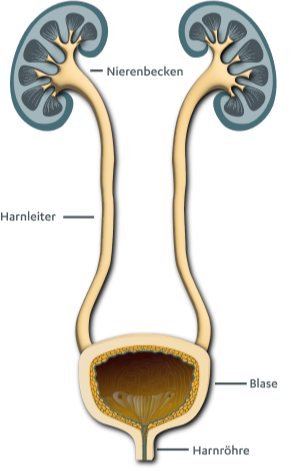
Was gehört zu den ableitenden Harnwegen?
Das Harnblasenkarzinom geht meist von der Schleimhaut der Harnblase (Urothel) aus. Das Urothel kleidet den gesamten Bereich der ableitenden Harnwege ausgehend von der Niere aus. Mehr als 90 % der Blasentumoren sind Urothelkarzinome, sie entstehen häufig an mehreren Stellen gleichzeitig.
Zu den ableitenden Harnwegen gehören das Nierenbecken, die Harnleiter (Ureteren), die Blase (Vesica urinaria) und die Harnröhre (Urethra). Nieren inklusive Nierenbecken und Harnleiter werden dem oberen Harntrakt zugeordnet. Davon unterschieden wird der untere Harntrakt mit Harnblase und Harnröhre.10
Welche Symptome deuten auf ein Harnblasenkarzinom hin?
- Hämaturie (Mikro- oder schmerzlose Makrohämaturie)
- Positive Urinzytologie
- Unspezifische Reizsymptome (Pollakisurie, Dysurie, Harndrangsymptome)6
Wie kann ein Urothelkarzinom diagnostiziert werden?
Urinsediment und -zytologie
Die Sensitivität ist abhängig vom Differenzierungsgrad der Tumoren. Bei G1-Tumoren ist die Sensitivität gering.
Sonografie der Blase und ableitenden Harnwegen
Durch eine Ultraschalluntersuchung können Harnstauungen oder Harnsteine ausgeschlossen werden.
Weißlicht- oder ggf. fluoreszenzbasierte Zystoskopie
Die floureszenzunterstützte Diagnostik wird bei multifokalen oder bei high-grade Tumoren in der Anamnese oder bei positiver Urinzytologie eingesetzt.
Endoskopie mit TUR (transurethrale Resektion) zur Histologiegewinnung
Bei zystoskopischem Verdacht soll ein histologischer Nachweis erfolgen.2
Wie werden die Urothelkarzinome klassifiziert?
Die Definition von Tumortyp, Tumorgrading und Tumorstaging soll nach WHO- und UICC-Klassifikation formuliert werden.6
- Das Risiko für ein intravesikales Rezidiv und für Progression wird beim NMIBC nach dem EORTC Risk Calculator ermittelt. Die AMWF unterscheidet die Risikogruppen: niedriges, intermediäres sowie hohes Risiko.6 Die EAU Guideline unterteilt das Risiko in niedrig, intermediär, hoch und sehr hoch.11
- Für die histologische Beschreibung invasiver Tumoren wird zusätzlich das dreistufige Gradingsystem (WHO – Klassifikation 1973) verwendet.6
Die Stadieneinteilung erfolgt nach den UICC-TNM-Kriterien.6
UICC-TNM Klassifikation der Urothelkarzinome
UICC-TNM Klassifikation | Tumor |
|---|---|
UICC-TNM KlassifikationTX | TumorPrimärtumor kann nicht bewertet werden |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
UICC-TNM KlassifikationT2a T2b | TumorTumor dringt in oberflächliche Muskularis propria ein (innere Hälfte) Tumor dringt tief in Muskularis propria ein (äußere Hälfte) |
UICC-TNM KlassifikationT3a T3b | Tumormikroskopisch makroskopisch (extravesikale Masse) |
UICC-TNM KlassifikationT4a T4b | TumorTumor dringt ein in Prostatastroma, Samenbläschen, Uterus oder Vagina Tumor dringt ein in Beckenwand oder Abdominalwand |
UICC-TNM KlassifikationNx | TumorRegionäre Lymphknoten können nicht bewertet werden |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
UICC-TNM Klassifikation | Tumor |
Tabelle 1: UICC-TNM Klassifikation der Urothelkarzinome, mod. nach6
Stadieneinteilung der Urothelkarzinome
Stadien-Einteilung | |||
|---|---|---|---|
Stadium 0a | Stadien-Einteilung | N0 | M0 |
Stadium 0is | Stadien-Einteilung | N0 | M0 |
Stadium I | Stadien-Einteilung | N0 | M0 |
Stadium II | Stadien-Einteilung | N0 | M0 |
Stadium IIIA | Stadien-Einteilung | N0 | M0 |
Stadien-Einteilung | N1 | M0 | |
Stadium IIIB | Stadien-Einteilung | N2, N3 | M0 |
Stadium IVA | Stadien-Einteilungjedes T | jedes N jedes N | M0 M1a |
Stadium IVB | Stadien-Einteilung | jedes N | M1b |
Tabelle 2: Stadieneinteilung der Urothelkarzinome, mod. nach6
EORTC Risk Calculator
Aspekt | Rezidiv-Score | Progressions-Score |
|---|---|---|
Aspekt1 2-7 >7 | Rezidiv-Score3 3 | Progressions-Score3 6 |
Aspekt≤ 3 cm ≥ 3 cm | Rezidiv-Score0 3 | Progressions-Score0 3 |
AspektPrimärer Tumor ≤ 1 Rezidiv/Jahr < 1 Rezidiv/Jahr | Rezidiv-Score0 2 4 | Progressions-Score0 2 2 |
AspektTa T1 | Rezidiv-Score0 1 | Progressions-Score0 4 |
AspektNein Ja | Rezidiv-Score0 1 | Progressions-Score0 6 |
AspektG1 G2 G3 | Rezidiv-Score0 1 2 | Progressions-Score0 0 5 |
Aspekt | Rezidiv-Score | Progressions-Score |
Tabelle 3: Wahrscheinlichkeit für ein Rezidiv und für Progress des NMIBC nach dem Punkte-Score der EORTC Risikoklassifikation, mod. nach6
EORTC Risikoscoring für NMIBC6
Faktor | Rezidiv-Wahrscheinlichkeit nach 1 Jahr | Rezidiv-Wahrscheinlichkeit nach 5 Jahren | Risikogruppe | ||
|---|---|---|---|---|---|
Faktor | Rezidiv-Wahrscheinlichkeit nach 1 Jahr | Rezidiv-Wahrscheinlichkeit nach 5 Jahren | Risikogruppe | 95 % CI | |
Faktor | Rezidiv-Wahrscheinlichkeit nach 1 Jahr | Rezidiv-Wahrscheinlichkeit nach 5 Jahren | Risikogruppe | (24-37) | Niedriges Risiko |
Faktor | Rezidiv-Wahrscheinlichkeit nach 1 Jahr | Rezidiv-Wahrscheinlichkeit nach 5 Jahren | Risikogruppe | (42-49) | Intermediäres Risiko |
Faktor | Rezidiv-Wahrscheinlichkeit nach 1 Jahr | Rezidiv-Wahrscheinlichkeit nach 5 Jahren | Risikogruppe | (58-65) | Intermediäres Risiko |
Faktor | Rezidiv-Wahrscheinlichkeit nach 1 Jahr | Rezidiv-Wahrscheinlichkeit nach 5 Jahren | Risikogruppe | (73-84) | Hohes Risiko |
Tabelle 4: EORTC Risikoscoring für NMIBC, mod. nach6
 Biomarker Testung
Biomarker Testung

Biomarker Testung: Subtypen, Tumortreiber und prädiktive Marker des Urothelkarzinoms
Klarheit durch Biomarker Testung
Biomarker können anzeigen, welche Tumortreiber der Erkrankung zu Grunde liegen. Molekulare Subtypen könnten eine bessere Stratifizierung von Blasenkarzinom-Patient:innen ermöglichen.12
Abhängig von den untersuchten Markern und der Methode kann die molekularbiologische Untersuchung am Gewebe oder mittels Blutproben erfolgen. Die gebräuchlichsten Methoden sind Immunhistochemie, PCR (polymerase chain reaction), traditionelle Sanger-Sequenzierung oder NGS (Next Generation Sequencing).13,14
Welche Tumortreiber sind beim fortgeschrittenen oder metastasierten Urothelkarzinom bekannt?
Als möglicherweise relevante Mutationen werden für invasive Tumoren FGFR, CDKN2A, PPARG, ERBB2, E2F3, TP53 und RB1 diskutiert, wobei die FGFR-Mutationen zu den besonders gut untersuchten Mutationen gehören.12
FGFR im Fokus: Häufige Treibermutationen beim Urothelkarzinom

Rund ein Drittel der Urothelkarzinome weisen FGFR-Alterationen auf.15 Es werden vier FGFR-Gene unterschieden, die sich in ihrer Struktur ähneln (FGFR1-4)15:
FGFR3 weist dabei am häufigsten Alterationen auf (15 %). Die Alterationen umfassen unter anderem die Mutationen S249C, R248C Y373C sowie die FGFR3-TACC3-Fusion.14,15
Weitere Genveränderungen sind FGFR1-Amplifikationen, Genfusionen, FGFR3-Amplifikationen.15
Beim low-grad/low risk NMIBC finden sich in bis zu 80 % der Fälle FGFR3-Mutationen.16
Welchen Einfluss hat FGFR auf die Onkogenese?
FGFR ist eine zellmembrangebundene Rezeptor-Tyrosinkinase. Nach Aktivierung beeinflusst FGFR verschiedene intrazelluläre Signalkaskaden über PI3K(Phosphatidylinositol-3-Kinase)-AKT, PLCɣ (Phospholipase Cɣ), STAT (signal transducers and activators of transcription) und RAS-MAPK (mitogen-activated protein kinase) Signalwege. Diese Signalwegkaskaden regulieren zelluläre Funktionen wie Proliferation, Differenzierung und Angiogenese. Eine Überaktivierung der FGFR-Signalwege durch Genamplifikationen, aktivierende Mutationen oder Genfusionen kann daher die Tumorentstehung und das Fortschreiten des Tumors begünstigen.17
Biomarker für die Immuntherapie mit Checkpoint-Inhibitoren
Programmed death-ligand 1 (PD-L1) Expression
Die Wirkung von Checkpoint-Inhibitoren kann mit der PD-L1 Expression auf Tumorzellen und Immunzellen im Tumorareal korrelieren. Die Bestimmung der PD-L1-Expression erfolgt immunhistologisch mit unterschiedlichen Scoring-Systemen: Der TCS (Tumor Cells Score) bzw. TPS (Tumor Proportion Score) gibt das Verhältnis von PD-L1-positiv gefärbten Tumorzellen bezogen auf die Gesamtzahl der Tumorzellen wieder. Der CPS (Combined Positive Score) ist definiert als das Verhältnis von positiv gefärbten Tumor- und Immunzellen zur Gesamtzahl der Tumorzellen multipliziert mit 100. Der ICS (Immune Cells Score) gibt die Anzahl der positiv gefärbten Immunzellen im Tumorareal an.
Tumormutationslast / Tumor Mutational Burden (TMB)
Der TMB-Wert stellt die Gesamtzahl aller Mutationen in einer Tumorprobe dar und ist bislang kein anerkanntes Kriterium für die Zulassung. Die Tumormutationslast ist jedoch ein weiterer prädiktiver immuntherapeutischer Biomarker. Die Bestimmung ist methodenabhängig und im Hinblick auf die Einfluss-nehmenden Faktoren schwierig.5,18
Könnten molekulare Subtypen eine bessere Stratifizierung von Patient:innen ermöglichen?
Muskelinvasive Blasenkarzinome werden nach molekularer Konsensus-Klassifikation in sechs Subtypen eingeteilt, die sich in den onkogenen Mechanismen, der Infiltration von Immun- und Stromazellen, den histologischen und klinischen Eigenschaften unterscheiden: 12,18
- luminal-papillär (24 %)
- luminal nicht spezifiziert (8 %)
- luminal instabil (15 %)
- stromareich (15 %)
- basal/squamös (35 %)
- neuroendokrinartig (3 %)
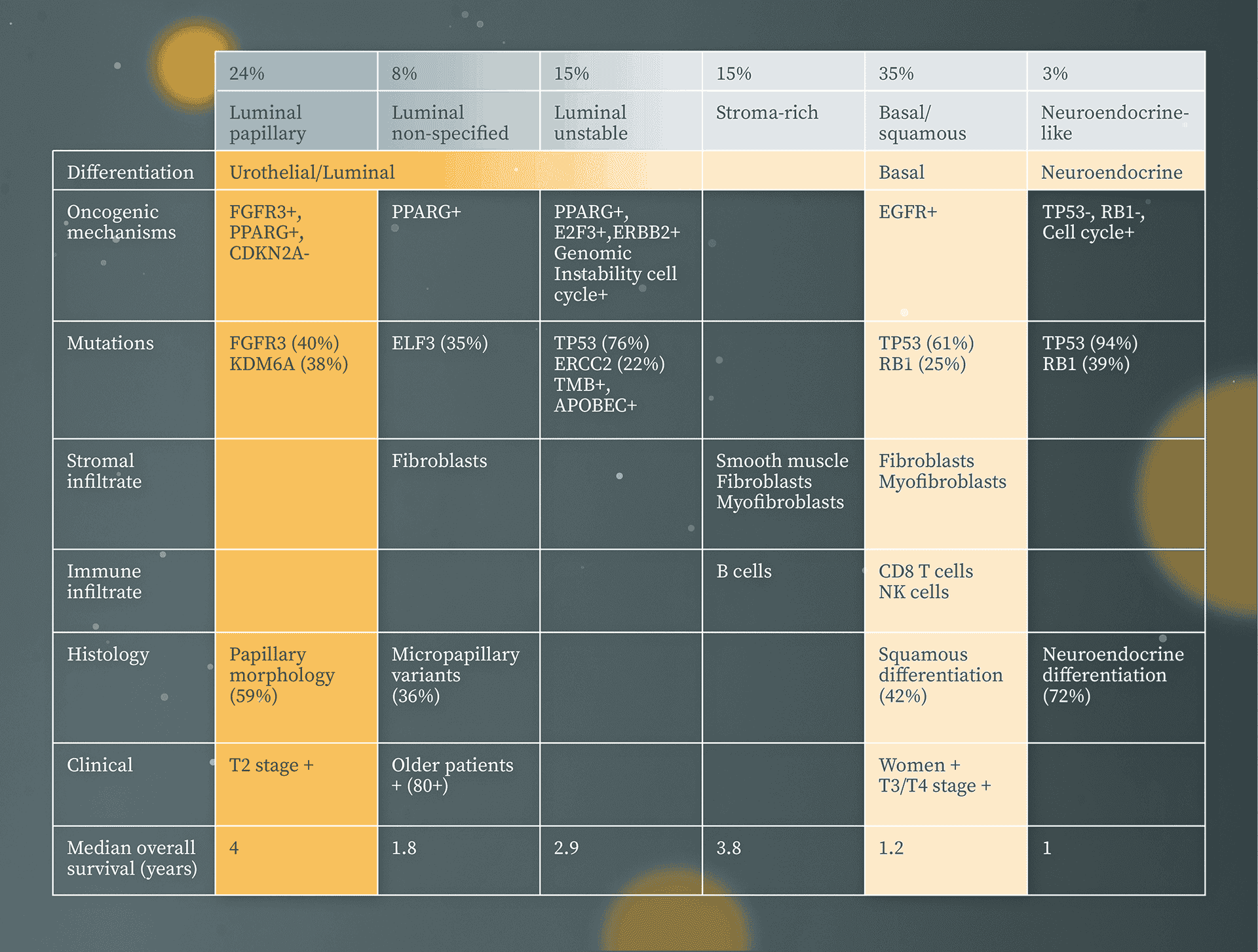
Luminal-papilläre MIBC weisen häufig Tumorzellen mit transkriptioneller FGFR3-Aktivität (Fibroblastenwachstumsfaktor-Rezeptor) und FGFR3-Alterationen (Mutationen, Fusionen oder Amplifikationen) auf. Die höchste Mutationslast und vermehrte ERBB2-Amplifikationen (erb-b2 receptor tyrosine kinase 2, HER2/neu) werden bei den luminal instabilen Karzinomen beobachtet. In Tumorzellen der basal/squamösen Karzinom-Gruppe finden sich häufig Veränderungen in den Genen TP53 (Tumorsuppressorgen) sowie RB1 (Retinoblastom-Protein) mit Überexpression von EGFR (Epidermal Growth Factor Receptor).16,21
 Therapieoptionen
Therapieoptionen

Therapieoptionen beim NMIBC, MIBC und metastasierten Urothelkarzinom
Für die Behandlung des Urothelkarzinoms stehen verschiedene Therapieoptionen zur Verfügung: chirurgische Verfahren, intravesikale Instillationen, Strahlentherapie und medikamentöse Therapien. Wichtige Kriterien für die Wahl der Therapie sind die Histologie des Karzinoms, das Tumorstadium und vorliegende Risikofaktoren.2
Blasenkarzinome in frühen Stadien können oftmals minimalinvasiv behandelt werden. Die Therapie eines fortgeschrittenen Karzinoms wird interdisziplinär mit allen beteiligten Fachbereichen in einem Tumorboard besprochen.2
Weiterführende Informationen finden sich auf den Seiten der Fachgesellschaften:
Therapieoptionen beim NMIBC, MIBC und mUC im Detail
Das oberflächliche NMIBC kann häufig durch eine transurethrale Resektion des Blasentumors (TUR-B) entfernt werden. Der Eingriff erfolgt durch die Harnröhre (Urethra). Darüber hinaus kann eine intravesikale Instillationstherapie mit einer Chemotherapie oder mit Bacillus Calmette-Guérin (BCG) gegeben werden. Bei hohem Rezidiv- oder Progressionsrisiko kann eine Zystektomie (Entfernung der Blase) empfohlen werden.2,11
Eine Standardtherapie beim MIBC mit kurativer Intention ist die radikale Zystektomie mit bilateraler pelviner Lymphadenektomie (Entnahme von 10-16 Lymphknoten aus dem Beckenraum). Die Prognose kann durch eine zusätzliche neoadjuvante oder adjuvante Therapie verbessert werden. Soll oder kann eine Zystektomie nicht durchgeführt werden oder wird diese abgelehnt, wird eine multimodale, primär organerhaltende Therapie mit einer TUR-B und anschließender Radiochemotherapie empfohlen.2
Die Therapieentscheidung beim mUC wird in Abhängigkeit vom Allgemeinzustand und Komorbiditäten getroffen,2 wobei der Kreatinin-Clearance, dem Hörvermögen, der peripheren Neuropathie und der Herzinsuffizienz besondere Beachtung geschenkt wird.6 Zugelassener Standard in der Erstlinienbehandlung des mUC ist die platinhaltige Chemotherapie.5
Ausbleibende Innovationen: platinbasierte Chemotherapie seit über 20 Jahren Standard5
In den letzten Jahrzehnten wurden verschiedene Chemotherapie-Regime mit unterschiedlicher Behandlungsdauer, Dosierung und verschiedenen Kombinationspartnern untersucht. Bei Patient:innen, die nicht für eine platinhaltige Chemotherapie geeignet sind, kann, im Falle einer entsprechenden PD-L1 Expression, alternativ eine Immuntherapie erfolgen.5
Im Anschluss an eine platinhaltige Chemotherapie erfolgt oftmals eine Immuntherapie mit Checkpoint-Inhibitoren. Im weiteren Verlauf können auch platinfreie Chemotherapien zum Einsatz kommen, die Behandlungsoptionen bleiben jedoch begrenzt.19
Etwa 25% der Patient:innen mit fortgeschrittenem oder metastasiertem Urothelkarzinom kommen für eine aktuelle Therapieoption nicht in Frage. Nach der Erstlinientherapie haben sogar zwei Drittel der Patient:innen keine weitere Behandlungsoption.4 Im Vergleich zu anderen Tumorentitäten stehen personalisierte, zielgerichtete Therapien beim Urothelkarzinom noch aus.16
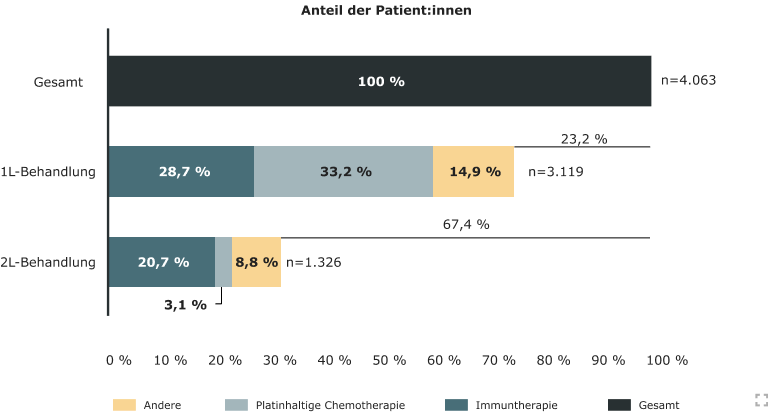
Behandlung von Patienten mit fortgeschrittenem und metastasiertem UC in der Erst- und Zweitlinie basierend auf Daten einer globalen, retrospektiven, beobachtenden Studie (2016-2020). (mod. nach 4)
 Nachsorge
Nachsorge

Nachsorge
Das empfohlene Nachsorgeprotokoll von NMIBC-Patient:innen hängt von der EORTC-Risikostratifizierung ab. Standard ist die zytoskopische Untersuchung zur Rezidiv- oder Progressionskontrolle. Weitere Untersuchungen abhängig von der Risikogruppen-Einteilung (niedrig, intermediär und hoch) sind die Urinzytologie, Urin-basierte Tumormarker, die Sonographie, das Ausscheidungs-Urogramm (AUG/IVU) oder das CT-Urogramm (CT-AUG) bzw. das MRT-Urogramm (MRT-AUG).
Das Nachsorgeschema von MIBC-Patient:innen hängt davon ab, ob eine radikale Zystektomie oder eine Radio-(Chemo-)Therapie als kurativ intendierte Therapie gewählt wurde. Untersucht werden Frührezidive, metabolische Veränderungen, funktionelle Störungen und der psychoonkologisch-soziale Status.2,6
Weiterführende Informationen finden Sie auf den Seiten der Fachgesellschaften:
Referenzen
- Krebs in Deutschland für 2017/2018. Berlin: Robert Koch-Institut (Hrsg.) und Gesellschaft der epidemiologischen Krebsregister in Deutschland e.V. (Hrsg); Stand November 2021.
- onkopedia leitlinien Blasenkarzinom (Urothelkarzinom). 2019.
- Niegisch G, et al. Journal of Clinical Oncology. 2023;41(6):464.
- Morgans A, et al. Annals of Oncology. 2021;32:S714-S5.
- Witjes J, et al. EAU Guidelines on Muscle-invasive and Metastatic Bladder Cancer. Edn. presented at the EAU Annual Congress Amsterdam 2022, 2023.
- S3-Leitlinie Früherkennung, Diagnose, Therapie und Nachsorge des Harnblasenkarzinoms. Berlin: AWMF, DKG und DKH; 2020.
- Castaneda P, et al. Front Oncol. 2023;13:1114203.
- Thomas J, et al. Cancers (Basel). 2022;14(7).
- Survival Rates for Bladder Cancer: American Cancer Society Inc.; 2023.
- PDQ Adult Treatment Editorial Board: Bethesda (MD): National Cancer Institute (US); 2002
- Gontero P, et al. EAU Guidelines on Non-muscle-invasive Bladder Cancer (TaT1 and CIS)2023.
- Kamoun A, et al. Eur Urol. 2020;77(4):420-33.
- Malone ER, et al. Genome Med. 2020;12(1):8.
- Franz A, et al. Die Urologie. 2023;7:696-704.
- Helsten T, et al. Clin Cancer Res. 2016;22(1):259-67.
- Inamura K. Cancers (Basel). 2018;10(4).
- Ornitz DM, et al. Wiley Interdiscip Rev Dev Biol. 2015;4(3):215-66.
- Rüschoff JH, et al. Die Onkologie. 2022;28:742-52.
- Okobi TJ, et al. Cureus. 2023;15(6):e40031.
Unser Angebot erfüllt die afgis-Transparenzkriterien.
Die afgis-Zertifizierung steht für hochwertige Gesundheitsinformationen im Internet. Die Prüfung durch insgesamt zehn umfangreiche Kriterien bestätigt, dass die Janssen Medical Cloud den medizinischen Fachkreis über gesundheitsrelevante Themen in seriöser, aktueller und qualitätsgesicherter Weise informiert.
EM-148885
